蔡启良PI带领本课题组发现靶向干预EB病毒潜伏感染的关键位点
近日,本课题组于病原学领域权威期刊PLOS Pathogens在线发表题为“STUB1 is targeted by the SUMO-interacting motif of EBNA1 to maintain Epstein-Barr Virus latency”的论文,首次报道了EBNA1含有SIM基序,为抗EBV相关癌症治疗提供了一个特异性潜在干预靶点。
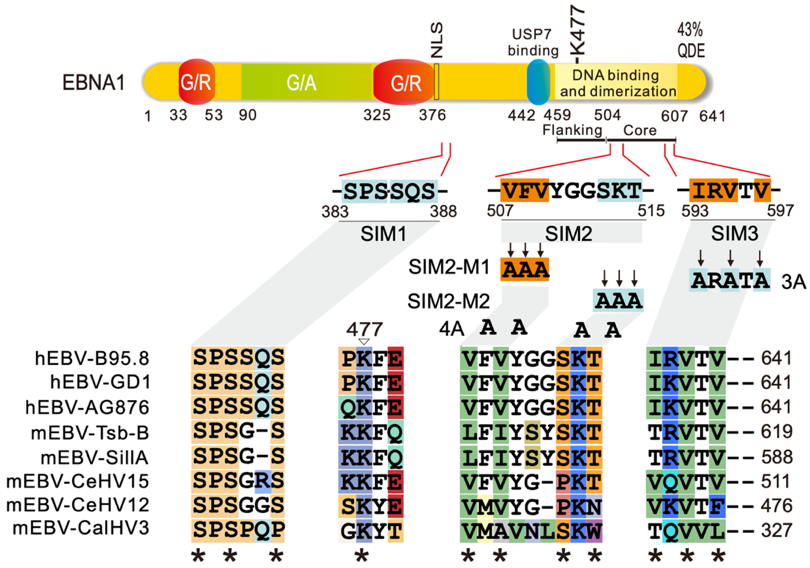
EB病毒(Epstein-Barr Virus,EBV) 又称人类疱疹病毒4型(HHV-4),是具有囊膜结构的双链DNA病毒,属于γ疱疹病毒亚科,于1964年从伯基特淋巴瘤(Burkitt’s Lymphoma, BL)中分离出来,也是第一个被发现的人类肿瘤病毒。EBV感染可导致多种人类恶性肿瘤,如感染B淋巴细胞引发霍奇金淋巴瘤(HL)、伯基特淋巴瘤等,感染上皮细胞引发鼻咽癌(NPC)和胃癌(GC)等,目前造成约2%的世界癌症死亡率,超过90%的世界人口无症状终身携带EBV。EBV具有典型疱疹病毒的生活周期:潜伏期和裂解复制期,EBV编码的核抗原1(EBNA1)是所有EBV相关肿瘤均表达的关键抗原,对维持EBV基因组DNA复制和调控病毒基因表达起重要作用。类泛素小分子(SUMO)化修饰是一种重要的蛋白质翻译后调控,主要参与调控基因转录等多种细胞生物学过程。EBNA1如何在蛋白质翻译后水平参与EBV潜伏感染维持调控的机制尚不完全清楚。
蔡启良PI带领本课题组历经近十年研究,先后发现了卡波氏肉瘤病毒(KSHV)在持续性感染的建立和维持,以及诱发肿瘤发生过程中的系列关键节点。KSHV编码的潜伏感染期关键抗原LANA蛋白存在一个能与细胞内SUMO2特异识别结合功能结构域(SUMO-Interacting Motif,SIM),对维持病毒基因组稳定至关重要,通过高通量药物筛选发现了一种源自藤黄属植物的天然小分子单体Cambogin,可有效地靶向抑制LANA-SUMO2蛋白间相互作用,是首个报道直接以病毒LANA蛋白为靶点的干预小分子化合物,对KSHV相关恶性肿瘤具有显著地靶向抑制功效。
据此,本团队再次发现EBV编码的EBNA1蛋白同样存在与SUMO相互作用基序(SIM),命名为EBNA1SIM,分别为位于EBNA1氨基酸第507-515位(SIM2)和593-597位(SIM3),在氨基酸第477位赖氨酸可发生SUMO化修饰,且这些位点在不同人源EBV病毒株及猴源EBV病毒株中高度保守。
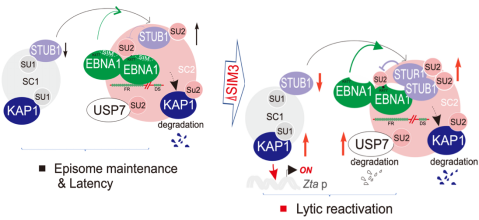
深入研究发现EBNA1SIM招募STUB1、KAP1和USP7等SUMO2化修饰的复合物(SC2),揭示了EBNA1需要该SIM来抑制STUB1、KAP1和USP7等SUMO2化修饰的复合物解离,从而维持潜伏期病毒基因组稳定传代和沉默裂解复制基因。此外,缺氧介导病毒裂解复制的再激活诱导EBNA1蛋白SUMO2化修饰及其与STUB1解离。
这一发现证实了病毒潜伏期抗原SIM基序可作为抗EBV、KSHV等病毒相关癌症治疗的一个通用特异性潜在干预靶点,不仅为调控EBV潜伏和裂解复制生命周期提供了新的理论依据和思路,而且对于干扰宿主和病毒之间的相互作用提供了新的见解。
复旦大学基础医学院医学分子病毒学重点实验室王玉燕副教授、都树娟博士生、朱彩霞助理研究员和王冲博士生(现哈佛大学博士后)为论文的共同第一作者,蔡启良研究员为论文的通信作者。该研究得到了国家自然科学基金、国家重点研发计划、国家重大基础研究项目支持。
文章链接:https://pubmed.ncbi.nlm.nih.gov/32176739/